12.09.2023
Натуральные и синтетические гидрогелевые матриксы, содержащие биоактивные компоненты, все чаще используются для решения различных задач тканевой инженерии. Введение плазмидных ДНК, кольцевых двухцепочечных молекул, кодирующих остеоиндуцирующие факторы роста, в такие каркасные конструкции является одним из перспективных подходов к доставке соответствующих генов в область костного дефекта для их замещения, обеспечивая пролонгированную экспрессию необходимых белков.
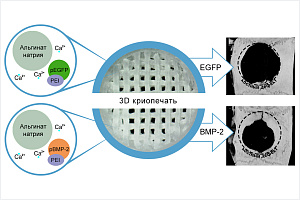
Группой ученых, в которую входили исследователи из Института фотонных технологий РАН ФНИЦ «Кристаллография и фотоника» РАН, впервые применен метод 3D криопечати для формирования ген-активированных трехмерных матриксов (ГАМ) на основе альгината натрия. Было произведено послойное нанесение полимерного раствора, содержащего плазмидные ДНК, на подложку в соответствии с данными трехмерной компьютерной модели, его последующее отверждение при -10 ℃ и гелеобразование. Это позволило не только быстро формировать сложные структуры воспроизводящие архитектонику восстанавливаемого тканевого фрагмента, но и добиться пролонгированного высвобождения генетических конструкций, кодирующих, в частности, усиленный зеленый флуоресцентный белок (EGFP), в течение 3 недель с поддержанием необходимой дозы для обеспечения эффективного синтеза целевого белка.
В исследовании учеными впервые проведена сравнительная оценка остеогенных свойств, сформированных гидрогелевых матриксов, содержащих плазмиду с геном костного морфогенетического белка 2 (BMP-2), как in vitro, так и in vivo. Методом ПЦР в реальном времени оценены уровни экспрессии генов маркеров остеогенной дифференцировки мультипотентных мезенхимальных стромальных клеток (ММСК). Остеогенез in vivo изучен на модели критического дефекта теменных костей крыс с использованием микро-КТ и гистоморфометрического анализа. В ходе эксперимента показано, что высвобождающиеся из ГАМ плазмидные комплексы обладают способностью проникать в ММСК, инициировать синтез BMP-2 и процесс остеогенной дифференцировки клеток. Через 8 недель после имплантации ГАМ, содержащих плазмиду с BMP-2, в костный дефект показаны миграция клеток вглубь матрикса и его активная васкуляризация, а также пятикратное увеличение объема новой кости по сравнению с контрольной группой.
Подробнее в журнале Gels.

